研究背景:PARPi已被批准用于治疗与各种DNA损伤修复(DDR)基因突变相关的转移性前列腺癌(mPC),但不同患者的临床获益有差异。同源重组修复(HRR)缺陷的生物标志物可能有助于完善患者分层,以指导更精确的治疗选择。该研究报告了一项来自Ⅱ期TOPARP-B试验(NCT01682772)的探索性分析,探讨了通过免疫荧光法对肿瘤活检病灶进行RAD51分析以评价HRR功能的预测价值。
研究方法:研究人员在临床试验中分析奥拉帕利治疗mPC患者原发病灶和转移病灶活检的福尔马林固定石蜡包埋(FFPE)。通过免疫荧光法(IF)检测Geminin阳性肿瘤细胞中RAD51和γH2AX病灶来评估基线HRR功能。所有的样本都是由两个不知道基因组和临床数据的、训练有素的判读者来评分的。当RAD51得分较低时,样本被认为是HRR缺陷(HRD),预定义为<10%的肿瘤细胞呈现≥5个RAD51病灶/细胞。通过卡方检验和对数秩检验分析RAD51评分、对奥拉帕利的治疗反应及患者生存(影像学无进展生存rPFS和总生存OS)之间的关系
研究结果:与既往临床试验中用于NGS的活检相同,本次探索性分析成功完成RAD51和γH2AX评分的患者也是有52例。所有肿瘤均表现出丰富的DNA损伤(γH2AX评分>40%)。两个盲读者的组内相关系数(ICC)为0.88。总的来说,52例患者中有22例(42%)根据低RAD51评分被定义为HRD。
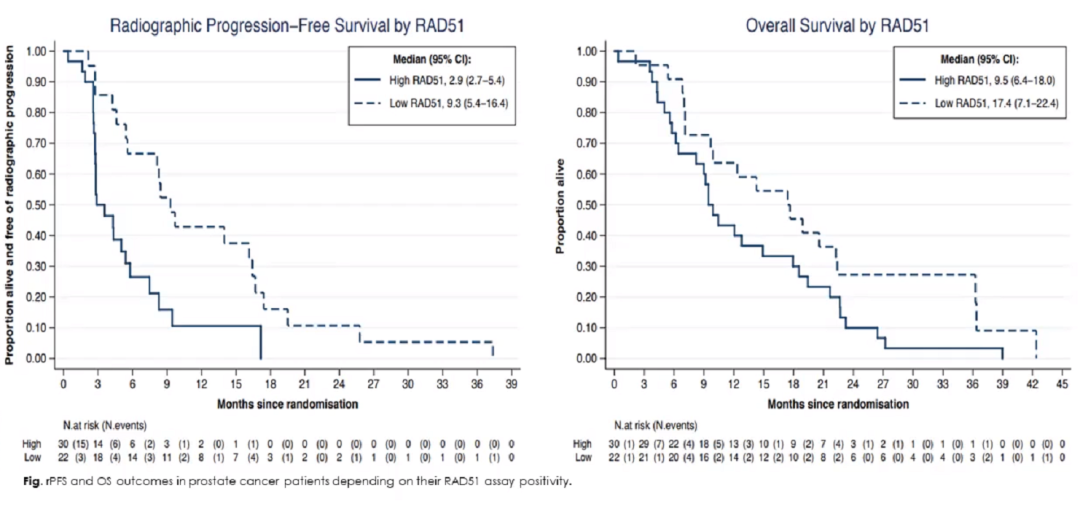
RAD51评分低与评分高患者的奥拉帕利治疗缓解率(基于复合RECIST/PSA/CTC试验标准)分别为15/22(68%)与7/30(23%)(P=0.001)。RAD51评分低患者给予奥拉帕利治疗的rPFS(9.3 vs 2.9个月,P=0.002)和OS(17.4 vs 9.5个月,p=0.05)也更长。
16例BRCA1/2突变者均表现为RAD51评分低。对于PALB2突变的患者,2/2例双等位基因缺失的患者RAD51评分较低,且对奥拉帕利治疗有反应,而2/2例单等位基因PALB2突变的患者RAD51得分较高,且对奥拉帕利治疗无反应。ATM和CDK12突变与RAD51评分低无关。事实上,10/11例ATM突变和8/10 例CDK12突变的肿瘤表现出较高的RAD51评分;在2例ATM突变和高RAD51评分的患者中观察到RECIST/PSA反应。
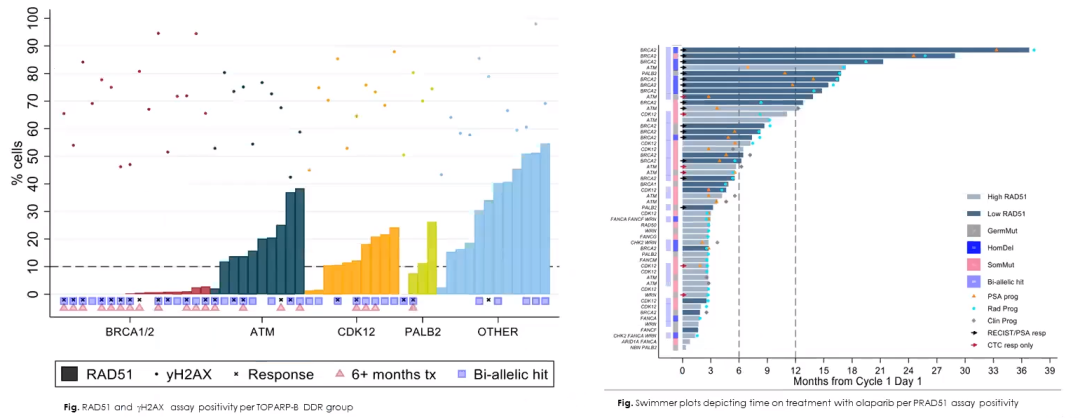
图2. (左)DDR人群的RAD51和γH2AX分析,(右)RAD51分析阳性患者给予奥拉帕利治疗过程的疗效游泳图
研究结论:对活检组织FFPE进行RAD51的免疫荧光法分析,可检测出HRR缺陷的前列腺癌,包括BRCA1/2和PALB2双等位基因突变,并可用于前列腺癌PARP抑制剂治疗的患者分层。有必要在更大的队列中进一步验证。
AACR的这篇研究基于TOPARP-B临床试验队列,对其中52例接受奥拉帕利治疗的前列腺癌患者进行RAD51免疫荧光表达评分,若病灶存在小于10%的RAD51表达阳性细胞定义为同源重组修复功能缺陷患者,研究结论证实基于RAD51表达评分能够较好评估前列腺癌同源重组修复缺陷(HRR deficiency),可作为前列腺癌PARP抑制剂获益的潜在预测标志物。
随着PARP抑制剂的在HRR基因突变型前列腺癌中的获批,前列腺癌已然迈入精准治疗时代。然而,单纯依靠HRR基因突变区分PARP抑制剂仍存在较大不足:综合TOPARP-A、TOPARP-B、PROfound、TRITON2、TALAPRO-1临床试验结果,我们发现即使是对于PARP抑制剂疗效最好的BRCA2突变患者,客观缓解率也仅为50%;而对于BRCA1突变患者,客观缓解率低至26.3%;而一些非HRR突变患者,由于表观遗传改变如甲基化等原因,却显示出PARP抑制剂获益的可能。
在HRR基因突变之外,目前最受关注的两个HRR deficiency评价指标为HRD score及RAD51表达评分。在卵巢癌中,多项临床试验证实了HRD score能够作为卵巢癌PARPi治疗获益的有效指标,并且,相比HRR基因突变,HRD score将受益人群扩大近两倍(~50% vs ~25%)。然而至今仍未有HRD score在前列腺癌PARP抑制剂相关临床试验中的数据披露。除此之外,HRD score基于肿瘤细胞基因组突变特征的改变,是一个静态指标,难以体现肿瘤细胞治疗进化过程中同源重组修复功能的改变。
从同源重组修复过程上,RAD51作为BRCA2蛋白的下游作用分子,结合单链DNA分子并启动同源重组修复。理论上,通过评估下游核心蛋白RAD51的表达,显然优于探索上游HRR突变或表观遗传改变等机制;并且,RAD51表达能够动态改变,体现肿瘤细胞实时的同源重组修复能力。一项基于28例人源乳腺癌异种移植瘤模型(PDX)的研究显示:RAD51表达评分指标PARP抑制剂疗效预测效能高于HRD score(ROC AUC: 1 vs 0.735)。
因此,对于这篇研究所展示的数据,我们期待已久。当然,我们也可以看到,RAD51表达评分亦非完美,在TOPARP-B临床试验队列中,同样存在31%的(7/22)患者低RAD51表达(HRR deficiency)然而对PARP抑制剂治疗并未响应,RAD51表达评分也未能准确区分出BRCA1/2突变但未能从PARP抑制剂治疗中获益的患者。PARP抑制剂的最佳疗效预测标志物仍然需要得到进一步的探索与验证。





 京公网安备 11010502033352号
京公网安备 11010502033352号